马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
Int. J. Mol. Sci. 2018, 19(10),2850; doi:10.3390/ijms19102850
Review
Pleiotropic Effects of Metformin on Cancer
二甲双胍对癌症的多效性
(全方位抗癌功能,只能是神药了.其他文献指出非糖尿病患者起步剂量1500mg每天,信不信你说了算)
Hans-JuergenSchulten
Received:20 July 2018 / Accepted: 14 September 2018 / Published: 20 September 2018
Abstract: 摘要
二甲双胍(MTF)是一种天然化合物,从豆科植物中提取。它是治疗2型糖尿病(T2D)的一线抗糖尿病药物。其主要抗糖尿病作用之一是降低肝葡萄糖释放量。第一个关于MTF抗癌作用的科学证据是在2001年发表的《动物研究》中发现的,几年后一项回顾性观察研究提供了证据,证明MTF与T2D患者降低癌症风险有关。它的多效抗癌作用在分子和细胞水平上进行了大量的体外和体内研究。尽管大多数研究表明MTF与某些抗癌特性有关,但临床研究和试验对其有益的抗癌效果给出了不同的看法。本文综述了MTF的多效性及其在基础、临床前和临床肿瘤研究中的应用最新进展。
1. Introduction引言
二甲双胍(MTF)是一种1,1-二甲基双胍,从豆科植物中提取,1957年首次作为抗糖尿病药物报道[1]。MTF是一种亲水性化合物,在生理条件下主要以带正电荷的形式存在。基于其安全性,MTF是治疗2型糖尿病(T2D)的一线抗高血糖药物,占诊断糖尿病的90%以上[2,3]。T2D的特点是肝脏、肌肉、脂肪组织和其他胰岛素抵抗组织中的胰岛素抵抗,导致高血糖和继发性高胰岛素血症[4]。MTF在糖尿病患者中的主要作用是降低血糖水平,导致胰岛素水平的二次降低。MTF在肝脏中的主要作用之一是降低糖异生作用和降低肝葡萄糖释放[5,6,7]。
与其他抗糖尿病药物相比,MTF仅表现出很少的副作用,如低血糖、高胰岛素血症、维生素B12缺乏、周围神经病变或极少发生乳酸性酸中毒,在超重患者中与糖尿病相关危险因素的相关性较低[8,9,10,11]。在某些条件下,胰岛素似乎与促进生长的作用有关[12]。1994年,美国食品和药物管理局(FDA)批准MTF用于T2D治疗。
将MTF与降低癌症风险联系起来的科学证据来自于对高脂喂养的仓鼠的研究,在MTF治疗的动物中,一种胰腺致癌物质未能诱导来自胰岛的胰腺癌[13]。相比之下,未接受MTF 治疗的仓鼠出现了癌变,而且与MTF治疗组相比,其增生性和癌前病变明显增多。流行病学研究表明,肥胖和T2D(而不是T1D)与某些癌症类型(包括肝、胆道、胰腺、结直肠、肾、膀胱、乳房和子宫内膜癌)的相对风险升高有关[3,14]。糖尿病和癌症患者共同的混杂因素是肥胖和缺乏体育活动。MTF在分子水平上作为氧化磷酸化(OXPHOS)抑制剂发挥主要作用,通过逆转抑制呼吸链NADH脱氢酶(线粒体复合物I)活性,从而抑制ATP的产生[15,16,17]。AMP活化蛋白激酶(AMPK)是MTF发挥其多效的关键分子[18]。MTF在分子和细胞水平上的抗癌作用的所有领域是体外和体内研究的主题。通过观察性研究、临床试验和荟萃分析来评估MTF对癌症治疗的有益效果。本综述旨在全面概述MTF在癌症研究中的应用,重点介绍MTF的潜在分子生物学效应。
2. MTF Bioavailability二甲双胍的生物利用度
MTF的细胞摄取和排出率主要取决于有机阳离子转运蛋白(OCT1、OCT2和OCT3)的表达以及多药和毒素挤出蛋白(MATE1和MATE2)[19]。MTF通过质膜单胺转运体(PMAT,别名,SLC29A4)和OCT3在顶膜处进入肠细胞,通过OCT1从肠细胞基底外侧膜向外运输[20]。OCT1和OCT3是MTF的肝细胞内流转运体,而MATE1是肝细胞外排转运体。MTF通过OCT2从循环中运输到肾上皮细胞,通过MATE1和MATE2运输到尿液。口服MTF主要通过小肠上部吸收,在这里它积累超过血浆浓度。值得注意的是,Oct1和Oct2转运蛋白的双敲除小鼠均显示MTF清除和分布显著减少,但大多不影响MTF的组织分布或药效学[21]。
口服MTF的生物利用度为40-60%[22]。1.5 g MTF剂量达到3 h后的血浆浓度峰值~ 18μM(~ 3毫克/升)[6]。MTF摄取依赖于剂量,但可饱和[23]。等离子体水平没有超过~ 30μM(~ 5 mg / L)的临床试验。肾功能正常且多次接受MTF应用的患者,血浆排除半衰期约为5-6小时[24]。大约90%的口服MTF通过肾脏排泄在24 小时内。一个探索性研究胰腺癌患者的二期研究发现,那些接受吉西他滨、埃罗替尼,和MTF (2 g每天),获得了MTF等离子体浓度> 1 mg / L,更有可能有OS的生存利益相比于MTF浓度较低; 然而,较高的MTF浓度不太可能发生在预后较差的晚期癌症和胃肠道疾病患者[25]。
MTF最大抑制浓度50%(IC50)在细胞系模型中为5 ~ 20mm,但在某些条件下有所不同。在乳腺癌细胞系中,MTF的IC50在高糖水平下升高,而MTF诱导的细胞凋亡和细胞周期阻滞在高糖水平下比低糖水平的低得多[26]。在细胞培养中,诱导AMPK活化需要1mm的MTF浓度[27]。这对应于一个细胞内的浓度131μM,类似于145μM小鼠血浆浓度接受腹腔内(i.p)注入的MTF。与口服MTF灌胃相比,i.p.给药可提高小鼠MTF生物利用度;特别是,它导致血液、肝脏和肾脏中MTF浓度显著升高,并刺激肾中葡萄糖类似氟脱氧葡萄糖(FDG)的保留[28]。在小鼠肿瘤模型中,静脉注射11C-MTF的生物分布显示肾脏和肝脏对示踪剂的摄取相对较高,而血液和肿瘤对示踪剂的摄取相对较低。作者认为,11C-MTF-正电子发射断层扫描(PET),可结合MTF敏感性相关的基因突变筛选,可以成为临床上识别MTF敏感肿瘤的可行方法。在老鼠模型,脂多糖诱导的系统性炎症、MTF浓度不同大脑区域之间不同浓度,最高的MTF测量在脑下垂体和脑脊液(~ 30μM) [29]。一项评论性的综述指出,在各种实验研究中证明的MTF的显著效果部分归因于超药理MTF浓度,在患者中不太可能达到 [20].。
3. Pleiotropic MTFEffects on Cancer: Basic and Preclinical Cancer Research
二甲双胍对癌症的多效性:基本和预临床癌症研究
本节包括18个部分,综述特定主题的二甲双胍多效性.
3.1. Mitochondrial andEnergetic Effects 线粒体和能量效果
在线粒体膜电位极化的情况下,MTF在线粒体基质中积累,通过抑制氧化还原和质子转移域的高效耦合导致ATP产生抑制,可逆转抑制呼吸链NADH脱氢酶(线粒体复合物I)[15,17,30,31,32]。其中一项研究,调查MTF在癌细胞线粒体复合体的抑制效果,使用MTF耐药的酒酵母NADH脱氢酶(Ndi1)过表达的细胞培养和异种移植小鼠,MTF治疗没有抑制肿瘤癌症细胞生长相比于参照组显示扩散受损[17]。值得注意的是,在对照组细胞中,MTF在葡萄糖剥夺的情况下诱导细胞死亡,而Ndi1过表达细胞则没有。
一项细胞培养系统的生化研究表明,MTF对癌细胞增殖的剂量依赖性抑制可能是由于MTF相关的线粒体复合物I抑制而导致代谢转化为糖酵解[33]。这就限制了葡萄糖和谷氨酸衍生的中间体进入三羧酸(TCA)循环,进而限制了脂质生物合成所需的乙酰辅酶a水平。值得注意的是,在AMPK缺陷细胞中也检测到了代谢转换,表明MTF的抗增殖作用并不依赖AMPK。此外,MTF不能抑制缺氧条件下的细胞增殖。
在啮齿类动物中,一项生化研究表明,氧化还原穿梭酶线粒体甘油-3-磷酸脱氢酶(GPDH)是另一种主要的MTF靶点,在此,细胞质的药物增加和降低线粒体氧化还原状态(在血浆和肝脏),减少乳酸和甘油转化为葡萄糖,减少肝糖异生[34]。使用与糖尿病患者相同的MTF浓度可以达到这些效果。在甲状腺癌中,与正常甲状腺组织相比,发现线粒体GPDH过表达[35]。细胞培养实验表明,具有高线粒体GPDH表达的甲状腺癌细胞更易受到MTF诱导的OXPHOS抑制作用。MTF对小鼠细胞培养和转移性甲状腺癌均有抑制作用。
己糖激酶II附着在线粒体外膜上,在癌细胞中高度表达[36,37]。细胞培养试验和分子建模研究表明,MTF通过占据葡萄糖-6-磷酸的结合位点,抑制己糖激酶II活性而直接损害葡萄糖代谢。这导致己糖激酶II从线粒体分离,导致凋亡信号的激活。癌细胞对ATP的需求高于非转化细胞, MTF治疗对其有重要影响。因此,癌症中的葡萄糖浓度通常比未受影响的组织的低3到10倍[38]。在低糖培养基中,要么影响复合物I亚基的线粒体DNA突变,要么葡萄糖利用率受损,与没有这些代谢障碍的细胞系相比,这些细胞对MTF或与MTF类似的抗糖尿病药物苯乙双胍更敏感。因此,在评估癌细胞对OXPHOS抑制剂如MTF的敏感性时,葡萄糖浓度是一个相当重要的因素。在乳腺癌细胞和未转化的对照细胞中,MTF降低了线粒体呼吸,导致ATP生成降低,增加了有氧糖酵解,相对而言,乳腺癌细胞糖酵解增加更大,无法弥补这些细胞维持增殖对ATP的更大需求[39]。
3.2. GastrointestinalTract Effects肠胃道作用
MTF在肝脏中的主要作用之一是减少糖异生,导致特异性降低肝脏葡萄糖的输出。最近的研究表明,胃肠道是MTF发挥其降血糖作用的另一个重要部位[23,40,41,42,43]。葡萄糖利用率的增加和乳酸的产生与MTF有关,而肠对这一效应起了相当大的作用[23,42,44]。值得注意的是,一项在小鼠身上进行的研究表明,肠道摄取葡萄糖-1- 13c会导致部分肝脏产生葡萄糖-1,6- 13c。这一过程可能与肠壁糖酵解和肝糖异生过程中ATP的净损失有关[44]。在这方面,一项在志愿者和啮齿类动物身上进行的代谢研究报告指出,血浆乳酸和丙酮酸浓度的增加与厌氧糖酵解的增加有关,众所周知,厌氧糖酵解产生的ATP少于有氧糖酵解的[45]。3.3. AMPK-DependentMechanisms AMP依赖的机制
AMPK被认为是细胞能量状态和关键细胞过程(如脂糖代谢、细胞生长、自噬和细胞凋亡)的主要调控因子之一[46]。维持线粒体内稳态的酶,当AMP或ADP与ATP比率增加时被激活。能量损失通过提高糖酵解来补偿。上游调控因子肝脏激酶B1 (LKB1)通过thr172位点的磷酸化直接激活AMPK,是MTH诱导AMPK活化所必需的[47]。细胞培养实验、免疫沉淀和下拉试验表明,AMPK的MTF激活需要LKB1与肌醇多磷酸盐多激酶(IPMK)相互作用[48]。此外,敲除实验表明,溶酶体通路对于AMPK的MTF激活是必要的[49]。
MTF通过磷酸化间接激活AMPK,进而下调关键脂生成转录因子甾醇调控因子结合转录因子1 (SREBF1 ,别名,SREBP-1)的表达,导致Fas细胞表面死亡受体(Fas)和核糖体蛋白S14 (S14)等脂源酶的下调[18]。
体外对前列腺癌和卵巢癌细胞的研究表明,MTF诱导的组蛋白增加和非组蛋白乙酰化需要LKB1/AMPK轴,通过AMPK介导乙酰辅酶a羧化酶(ACC) 增加磷酸化的抑制[50]。通过磷酸化灭活ACC也是促进脂肪酸氧化的机制之一。在肝细胞中,MTF通过间接激活AMPK,导致ACC活性降低,诱导脂肪酸氧化,抑制脂肪生成酶的表达[18].
在肝细胞中使用可逆AMPK抑制剂复合物C,可以逆转MTF引发的葡萄糖生成抑制。雷帕霉素(mTOR)复合物1 (mTORC1)的机制靶点包括mTOR的重要组成部分和mTOR复合物1 (RPTOR)的骨架蛋白调控相关蛋白,在AMPK下游起作用,代表另一个重要的代谢调控因子。抑制mTORC1的最低水平的MTF需要AMPK和结节硬化复合体蛋白复合体(TSC复合体)来传递信号[51]。
3.4. AMPK-IndependentMechanisms AMP独立的机制
除了AMPK介导的MTF作用外,还有几种AMPK独立的机制被描述,强调了MTF在癌症中的多效作用[30,52].一个AMPK 独立的MTF降低血糖水平机制涉及抑制胰高血糖素信号。在体外和体内实验表明,MTF通过一种机制抑制肝细胞中胰高血糖素依赖的葡萄糖输出,这种机制涉及AMP和相关核苷酸的积累,抑制腺苷环化酶,降低环AMP水平,降低蛋白激酶A活性[53,54]。敲除小鼠AMPKα1 AMPKα2催化亚基表明MTF阻碍肝脏糖质新生通过减少肝能量状态独立于LKB1 / AMPK通路[55]。
在肝癌细胞系中,缺氧诱导因子1亚单位alpha (HIF1A)蛋白的积累被MTF介导的HIF1A蛋白降解所损害,证明了MTF独立于AMPK的效应机制[56]。
小鼠肝癌异种移植中HIF1A的免疫组化表达降低支持了这一发现。此外,显示降低表达溶质载体家族2成员1 (SLC2A1;别名,Glut1)和碳酸酐酶9 (CA9;别名,CAIX)。
在p53基因完整的前列腺癌细胞中,MTF在减少增殖方面比p53活性受损或缺失的更有效[57]。这一观察结果可能对前列腺癌使用MTF有一定的意义,因为相当多的病例都有p53突变。此外,在完整p53前列腺癌细胞中,MTF诱导的DNA损伤诱导转录4 (DDIT4,别名,REDD1)上调介导了MTF不依赖于AMPK的抗增殖作用。DDIT4是p53的直接靶点,其诱导表达与mTOR表达抑制有关。
3.5.Micro RNAs 微RNA
微RNAs (miRNAs)与基因表达调节有关,通常在癌症中失调。细胞培养实验表明,MTF对许多miRNAs发挥调控作用[58,59]。据报道,MTF治疗后上调的miRNA包括let-7 miRNA、miR-26a和miR-34a,而miR-181a、miR-221和miR-222则下调。就miR-26a而言,MTF治疗和这种miRNA表达的增加导致了肾癌细胞生长抑制和乳腺癌细胞活力受损[60,61]。BCL2、凋亡调节因子是MTF治疗所下调的基因之一
3.6. Stress Effects 压力(应激)作用
限制的能量供应和约束的血管化使肿瘤细胞对压力敏感。MTF对癌细胞的主要作用之一是增强能量压力,特别是在低葡萄糖水平下。这一事实对与压力相关的机制有进一步的影响,如下面的调查所示。通过抑制线粒体复合物I,MTF使细胞对葡萄糖剥夺敏感,因为内质网介导的未折叠蛋白应答(UPR)需要一个功能呼吸链来激活,以减少应激条件下内质网未折叠蛋白的积累[62]。
已做了MTF在癌细胞培养和移植瘤小鼠中的应激相关效应的研究[63]。MTF治疗由于内质网到线粒体的钙通量导致内质网应激引起线粒体肿胀。尽管MTF在移植瘤中具有抗肿瘤作用,但这一过程启动了抗凋亡应答机制。
上调应激相关因素包括DDIT4和DDIT3,后者是与ER应激介导的凋亡相关的促凋亡因子。
在癌症细胞的体外和体内实验表明叉头盒O3 (FOXO3)是代谢应激下的关键转录因子,在此条件下以裂解形式转位到线粒体,支持线粒体代谢;不过,MTF治疗通过AMPK介导线粒体FOXO3的促凋亡作用[64]。
MTF治疗卵巢癌细胞增强了线粒体去乙酰酶3(SIRT3)的激活,增强了MTF引发的凋亡、能量应激和线粒体功能障碍,并增加了AMPK过表达[65]。
已知活性氧(ROS)是氧化应激的来源。在耐阿霉素乳腺癌细胞株MCF7/ADR中,MTF以一种时间和剂量依赖性的方式损害线粒体膜电位[66]。在低糖但不缺氧条件下,MTF短期培养后ATP水平降低,ROS水平升高。此外,本研究在异种移植小鼠模型中证实MTF瘤内注射以浓度依赖的方式损害肿瘤生长。
3.7. AntiproliferativeEffects 抗增殖作用
MTF的核心分子机制之一是对癌细胞的生长抑制作用,根据环境的不同,可能会产生进一步的细胞后果。
采用不同的细胞培养模型分析MTF诱导的抗增殖作用的相关分子事件。例如,在结直肠癌细胞中,MTF (5mM)治疗抑制了细胞的增殖和迁移,导致G0/G1细胞比例较G2周期细胞增加[67]。MYC (别名, c-Myc)、磷酸化RB转录相关因子1 (p-RB1)和细胞周期 D1 (CCND1)的表达均出现下降,与G1/S的转换有关。此外,通过减少位点特异性磷酸化,MTF治疗轻度抑制mTOR,并更显著抑制核糖体蛋白S6 (RPS6)和4E结合蛋白1 (4EBP1)。然而,在所有被检测的细胞系中,这种效应与增强的p-AMPK无关。已知mTOR/S6/4EBP1轴的抑制会影响蛋白质的合成。结直肠细胞系中的药物清除挽救了细胞增殖和胰岛素样生长因子1受体(IGF1R)和mTOR通路分子,重新激活的磷酸化。此外,在两种结直肠细胞系中,同时发生强烈的线粒体去极化与增加的ROS产生,这有助于抗增殖的MTF效应。MTF还能抑制含有G蛋白偶联受体5 (LGR5)和CD44的富亮氨酸重复序列干细胞基因的表达。研究人员探讨,在他们的实验中没有细胞凋亡可能是由于细胞是在低密度条件下培养的,从而降低了MTF诱导的细胞毒性酸中毒的作用。
MTF (10mM)治疗结肠癌LoVo细胞损害细胞活力[68]。细胞代谢谱显示能量代谢的失调是随时间变化的,例如谷氨酸水平升高(8小时、24小时和48小时),而谷氨酰胺水平最初升高(8小时),但长期细胞培养(48小时)降低。
在头颈部鳞状细胞癌的异种移植小鼠模型中,MTF治疗后(5天,200 mg/kg, i.p.注射)的光声成像显示肿瘤氧饱和度和血红蛋白浓度显著增加[69]。此外,肿瘤体积和增殖标记物Ki67的免疫染色下降,而血管浓度标记物、血小板和内皮细胞粘附分子1 (PECAM1; 别名CD31)保持不变。
MTF以剂量和时间依赖性的方式抑制骨肉瘤细胞的增殖、迁移和侵袭,这种作用与磷酸化AKT丝氨酸/苏氨酸激酶1 (p-Akt)和波形蛋白 (VIM)表达降低、PTEN和钙黏蛋白 1 (CDH1)表达增加有关[70]。表达谱分析研究雌激素受体阳性的乳腺癌细胞MCF-7,证明MTF的抗增殖作用主要是由于转位抑制mRNAs的细胞周期调控和肿瘤启动子,如细胞周期蛋白E2(CCNE2)和鸟氨酸脱羧酶1(ODC1),它们通过mTORC1/4EBP蛋白通路调节[71]。众所周知,MTF抑制这一通路。
3.8. Inhibition ofEpithelial-to-Mesenchymal Transition 抑制EMT
上皮-间充质转化(EMT)是促进肿瘤进展的关键过程。转化生长因子beta 1(TGFB1; 别名,TGF-β)是一种EMT过程的诱导基因。在接受MTF治疗的乳腺癌患者中,TGFB1血清水平呈下降趋势[72]。在肺腺癌细胞中,MTF通过LKB1/AMPK轴剂量依赖性地抑制TGFB1诱导的SMAD家族成员2/3 (Smad2/3)的磷酸化[73]。此外,MTF抑制TGFB1靶基因纤溶酶原激活子1型抑制子(PAI1别名,SERPINE1),纤连蛋白(FN),结缔组织生长因子(CTGF),白细胞介素6 (IL6)的表达; 这些研究和其他一些研究(其中一些是在不同的背景下提出的(第3.15和3.18节)表明,在某些条件下,MTF能够抑制EMT过程。
3.9. AntiangiogenicEffects 抗血管生成作用
血管生成抑制剂的应用已成为癌症治疗的一种治疗干预手段。其中一项研究评估了MTF在临床背景下的抗血管生成能力,该研究对少数糖尿病合并代谢综合征患者切除的肝细胞癌进行了研究[74]。在接受MTF药物治疗的患者中,肿瘤中血管内皮生长因子受体(VEGFR)的表达相对较低。其他下调的分子包括p-mTOR、CCND1和核糖体蛋白S6激酶B1 (RPS6KB1)。
子宫平滑肌瘤细胞在正常条件下的细胞培养实验表明,MTF以剂量依赖性的方式下调VEGF蛋白水平[75]。在类似缺氧条件下,MTF通过抑制mTORC1活性抑制HIF1A蛋白的合成。
在宫颈癌裸鼠异种移植模型,MTF治疗减少肿瘤生长和血管生成,这种效应与降低抑制剂mir - 142 - 3p绑定到肺腺癌相关联的长无编码RNA转移记录1(MALAT1)未翻译区(3′UTR),此在许多癌症类型也被称为肿瘤启动子 [76]。同时MTF治疗降低了结构转录因子的表达高迁移组AT-hook 2(HMGA2),被认为是mir - 142 - 3p绑定到HMGA2序列3′UTR的效果。移植乳腺瘤小鼠模型,MTF治疗导致降低血小板和内皮细胞粘附分子1 (PECAM1;别名, CD31),PECAM1作为内皮细胞标记物检测血管分支的变化[77]。肿瘤中核HIF1A水平也下降。
3.10. Autophagy 自噬
自噬可以促进癌细胞在应激条件下的存活,但也可能凋亡。AMPK被认为是自噬的关键调节基因之一[46]。在石川子宫内膜癌细胞中,MTF治疗上调细胞周期蛋白依赖性激酶抑制剂1A(CDKN1A; 别名,p21),导致更多的细胞阻滞在G1和G2/M阶段 [78]。通过将自噬体成分LC3BI转化为LC3BII可检测到自噬增加,自噬体靶蛋白p62水平下降。此外,诱导细胞凋亡,特别是在MTF浓度较高(10mM)时。通过caspase (CASP3/7,-8,-9)活性检测细胞凋亡,siRNA静默抑制自噬调节因子beclin1 (BECN1)导致MTF 治疗的细胞凋亡减少。
食管鳞癌细胞的研究表明自噬可以保护细胞凋亡[79]。此外,MTF处理通过减少磷酸化信号转导和转录激活子3 (STAT3)灭活及降低下游靶蛋白BCL2的表达。肿瘤抑制基因p53在约50%的人类癌症中发生突变。在p53野生结肠癌异种移植中,MTF治疗不影响肿瘤生长,而是启动了自噬,而在p53缺陷的结肠癌异种移植中,MTF选择性地抑制肿瘤生长并诱导细胞凋亡。这些相反的发现是由于在这些条件下MTF对p53缺陷细胞的特异性细胞毒性作用[80]。
3.11. Apoptosis 凋亡
MTF的主要抗癌作用之一是在一定的细胞应激条件下诱导细胞凋亡。一些研究已经研究了与细胞凋亡过程相关的分子效应。在MCF-7乳腺癌细胞中,MTF (10mM)治疗导致G1期细胞周期阻滞,持续降低细胞存活率,并在治疗后72小时诱导凋亡[81]。增加p53、CDKN1A、BCL2相关X、凋亡调节基因(BAX)、BCL2相关细胞死亡激动子(BAD)水平,并降低Akt、CCND1、BCL2、MDM2原癌基因(MDM2)水平,均可介导上述效应。
在结肠癌细胞HT29,MTF同时诱导自噬和凋亡。在分子水平上,MTF呈时间和剂量依赖性增加凋亡肽酶激活因子1(APAF1)、裂解聚(adp -核糖)聚合酶1 (PARP1)、自噬体标记微管相关蛋白1轻链3 (MAPLC3)、CASP3蛋白表达,同时减少核因子、类红细胞2样2 (NFE2L2别名, NRF2)和核因子-kappa B (NFKB))表达[82]。
对胰腺癌细胞的研究表明MTF治疗可以抑制细胞增殖并诱导细胞凋亡。这些效应与转录因子Sp1、Sp3、Sp4以及促癌基因Sp调控基因(如BCL2、mTOR、VEGF和MYC)的表达减少有关,表明MTF作为抗癌药物的潜在机制之一涉及靶向Sp因子[83,84]。
葡萄糖浓度在MTF诱导的凋亡过程中起作用。在HepG2肝癌细胞的综合代谢组学研究中,在高糖浓度下,高剂量的MTF介导血糖过低,减少肿瘤细胞增殖,通过激活AMPK/mTOR信号通路介导细胞凋亡[85]。在2个甲状腺癌细胞系中,MTF (5mM)在低(5mM)而不是高(20mM葡萄糖浓度时诱导细胞死亡和肿瘤坏死[86]。这种效应可能是由低ATP水平引起的,这可能是低糖培养基导致细胞死亡。类似地,MTF在不同乳腺癌细胞系中以低葡萄糖浓度诱导凋亡的细胞死亡,而在超生理条件下的葡萄糖浓度首先导致细胞周期阻滞[87]。
正常葡萄糖浓度下诱导细胞死亡的机制与MTF介导的MYC抑制有关[88,89]。相反,在高糖条件下,MYC表达不受MTF抑制,MYC诱导丙酮酸脱氢酶激酶1 (PDK1)上调,抑制丙酮酸脱氢酶(PDH),导致糖酵解通量增强,抵抗MTF诱导的细胞毒性作用。
3.12. Immune-MediatedAntitumor Response 免疫介导的抗瘤应答
许多研究已经证明MTF能够调节癌症中的免疫应答。例如,一种免疫介导的抗肿瘤应答在野生型小鼠中被证实,口服MTF保护CD8+肿瘤浸润淋巴细胞免于凋亡,并通过产生细胞因子和促进对高度免疫原性肿瘤的排斥来增强其多功能性[90]。
在小鼠黑素瘤细胞的肺转移中,MTF治疗引起局部和全身的抗癌免疫应答,特定T细胞群的肺浸润与MTF诱导的抗转移作用相关[91]。值得注意的是,与野生型小鼠相比,免疫缺陷小鼠仅表现出轻微的MTF抗转移作用。
使用小鼠的恶性肿瘤模型,MTF导致M1样巨噬细胞的积累,与M2样巨噬细胞相比,减少了肿瘤的生长和血管生成[92]。此外,高MTF浓度(每天300 mg/kg)可以降低移植瘤中VEGF和成纤维细胞生长因子2 (FGF2)的表达。
3.13. EpigeneticFeatures 表观特征
对组蛋白修饰和DNA甲基化的影响与癌症细胞MTF治疗有关,可能通过改变基因调节来促进其抗癌特性[58]。例如,一系列细胞培养实验评估了MTF对改变DNA甲基化模式的影响[59]。通过AMPK激活,MTF上调let-7的miRNA,导致长链无编码RNA H19失调。H19的失调减轻了对s -腺苷同型半胱氨酸水解酶(SAHH)的抑制,而s -腺苷同型半胱氨酸水解酶(SAHH)又促进了DNA甲基转移酶3B (DNMT3B)活性,从而调节甲基化模式。
这些mtf诱导的表观遗传效应也在子宫内膜癌标本中被发现。在正常血糖水平(5.5 mM)的卵巢癌中,MTF比在高血糖水平(25 mM)下更敏感,可通过AMPK活化修饰表观遗传谱,提示组蛋白H3赖氨酸27三甲基化(H3K27me3)和多梳抑制复合体2 (PRC2)的组分表达被抑制 [93]
3.14. HematologicalMalignancies血液恶性肿瘤
研究MTF对血液学恶性肿瘤的作用并不常见。在两个多发性骨髓瘤细胞系中,MTF浓度最高可达到20mM诱导抗增殖作用、自噬和G0/G1细胞周期阻滞,但未引起细胞凋亡[94]。此外,MTF增加了p-AMPK表达,减少了p-mTOR (ser2448和ser2481)表达,抑制了mTORC1和mTORC2信号通路,减弱了4EBP1和p-Akt(ser473)等转录关键蛋白的表达。在多发性骨髓瘤异种移植小鼠模型体外发现,MTF治疗(每天250 mg/kg)减少肿瘤大小、增加p-AMPK的表达、减少p-mTOR和Ki67的表达。
在4个淋巴瘤细胞系中,我们确定了4种药物的IC50(单药或与MTF (10mM)联合使用),结果表明应答是细胞类型特异性的[95]。在淋巴瘤细胞系亚群中,MTF联合BCL2抑制剂venetoclax和CDK9抑制剂BAY-1143572对降低IC50有明显的加性作用。在早幼粒细胞白血病细胞中,抗高血压药物乙酯利血平 (5mM)将MTF的IC50从约30mM降低到约2mM,显著提高了MTF诱导细胞死亡的敏感性[96]。
3.15. Cancer StemCells 癌症干细胞
肿瘤干细胞(CSCs)被认为是肿瘤启动和促进细胞数量,并与癌症的化疗和放疗耐药有关。在体外,CSCs能够形成肿瘤球体,在体内,它们能够在免疫缺陷条件下从少量细胞中产生肿瘤。CSCs表达一组共享的、独特的干细胞标记物,包括CD44和CD133,它们是不同肿瘤类型的特征[97]。CSC研究中常用的模型系统是乳腺癌和胶质瘤细胞。
小鼠异种移植乳腺上皮细胞模型显示皮下注射MTF以CD44高表达和CD24低表达CSC细胞为靶点,当与以非癌症干细胞为靶点的蒽环类化合物阿霉素联合使用时,协同抑制肿瘤生长[98]。作者得出结论,这两种药物的选择性靶向能力为其在乳腺癌治疗中的应用提供了理论依据。HER2过表达乳腺癌细胞系,曲妥珠单抗耐药,乳房癌初始CD44 + CD24 - /低数量细胞比非CD44+ / CD24 - /低数量细胞更敏感于MTF治疗 (估计MTFIC50 1±0.2 mM vs11±2 mM)[99]。MTF联合曲妥珠单抗显著降低了小鼠移植瘤的生长,表明这两种药物的联合可能获得临床意义。
从人乳腺腺癌衍生的CSCs细胞死亡,其特征为CD44高/CD24低表达谱,在二型糖尿病患者中应用的浓度范围MTF优先介导其死亡[100]。来自乳腺肿瘤细胞的CSCs代谢谱显示,MTF治疗可导致叶酸和同型半胱氨酸水平升高,与苯乙双胍类似,核苷酸三磷酸(NTPs和dNTPs)水平耗尽可能是受损的OXPHOS导致的[101]。
利用从不同的人多形胶质母细胞瘤(GBM)样本中提取的干细胞启动细胞作为转录因子,MTF激活AMPK,进而激活分化标记物FOXO3[102]。干细胞激活导致细胞的分化,神经干细胞/祖标记巢蛋白 (NES),武藏RNA结合蛋白1 (MSI1)和BMI1原癌基因,多梳无名指(BMI1) 表达降低和分化标志物胶质原纤维酸性蛋白(GFAP)和βIII-tubulin表达升高所表示。将培养基的葡萄糖浓度从26.2 mM降至17.5 mM,使AMPK和AMPK下游靶细胞ACC磷酸化效率更高。注射MTF (500 mg/kg)并不会显著损害移植瘤的生长,移植瘤是由移植的干细胞样胶质母细胞形成的。
然而,再植入裸鼠的分离细胞显示出继发肿瘤生长受损,表明MTF治疗导致干细胞样胶质母细胞耗尽。
MTF (10mM)应用于从IV期胶质瘤建立的脑肿瘤起始细胞(BTIC)细胞系中,对已建立细胞系的一个亚群的迁移和增殖具有抑制作用[103]。在一个MTF敏感的BTIC细胞系,在低MTF浓度(每天三次0.01 mM)时,增殖被显著抑制,根据报告,这很可能在人类脑肿瘤中实现。在两个GBM细胞系中,MTF能够抑制CSCs标记物MSI1、BMI1、SRY-box 2 (SOX2)以及锌指E-box结合同源异构体1 (ZEB1)的表达,后者又称关键的EMT相关转录因子[104]。
此外,MTF通过下调EMT相关因子钙黏蛋白2 (CDH2,别名 N-cadherin (N-cadherin)、波形蛋白(VIM)和snail家族转录抑制因子1和2 (分别是SNAI1和SNAI2)而抑制TGFB1启动的EMT样过程。
在n -甲基-n -亚硝基脲诱导的膀胱癌大鼠模型中,MTF不能抑制膀胱癌的发生,但可抑制从轻度到中度/重度异常增生以及从原位癌到浸润癌的进展[105]。MTF治疗增加了肿瘤中凋亡细胞的数量,减少了干细胞标记角蛋白14阳性细胞的数量(KRT14; 别名,CK14)和POU类5同源框1 (POU5F1; 别名,OCT3/4)。低浓度(<10 mM)MTF通过降低线粒体编码细胞色素c氧化酶II (MT-CO2; 别名,COX2),前列腺素E (PGE2), p-STAT3的蛋白水平而减少CSC细胞的数量。
这些和其他没有提到的CSC研究表明,MTF具有特异靶向CSCs的能力清除肿瘤细胞,这些细胞来自于那些具有化学抵抗能力,并形成最具增殖活性和侵犯性的肿瘤细胞群。最近的一篇综述中详细介绍了MTF作用于CSCs在分子水平上的各种机制[97]。MTF能够通过Akt/PI3K/mTOR、胰岛素/IGF1、丝裂原活化蛋白激酶(MAPK)、Sonic hedgehog (Shh)、Wnt、TGFB、Notch和NF-KB等信号通路靶向CSCs。
3.16. MTF inCombination with Other Anticancer Drugs 二甲双胍联合其他抗癌药物
在化疗方案中添加MTF是一种提高药物敏感性的策略。一些在体外和体内的研究已经探索了MTF与其他化合物或药物的各种联合,旨在优化和调整治疗方案。2-脱氧-d -葡萄糖(2DG)是一种AMPK激活剂和竞争性糖酵解抑制剂,经常包括在联合方案。胃肠癌、脑癌、肺癌、肝癌、乳腺癌、卵巢癌和胰腺癌的模型通常用于评估联合抗癌效应。
在人胃癌、食管癌细胞系和移植瘤小鼠模型中,MTF联合2DG有效抑制能量通路,明显导致细胞死亡,同时减少细胞ATP,延长AMPK活化,支持自噬[106]。在结直肠癌细胞中,奥沙利铂联合MTF导致协同细胞毒性,高迁移率族box 1 (HMGB1)表达受限,是细胞死亡和存活的调节因子[107]。在对细胞外基质脱离(anoikis)诱导的程序性细胞死亡具有耐药性的三阴性乳腺癌细胞中,MTF与2DG联合治疗抑制细胞增殖、诱导细胞脱离的效果较单一药物更明显[108]。
在非小细胞肺癌(non-small cell lung cancer, NSCLC)细胞系中,MTF联合抗IGF1R抗体抑制IGF1R信号,MTF与抗IGF1R联合对细胞活力有加性抑制作用[109]。在对EGFR酪氨酸激酶抑制剂(TKIs)耐药的NSCLC细胞系中,使用泛组蛋白去乙酰化酶抑制剂伏立诺他和MTF协同提高了对EGFR- tki 吉非替尼的敏感性[110]。介导凋亡蛋白BCL2样11 (BCL2L11; 别名,BIM)可以诱导细胞凋亡敏感性,而MTF可以显著降低自噬。神经胶质瘤是最具侵袭性的肿瘤之一,化疗的选择有限,部分原因是由于较大分子不能通过血脑屏障。然而,MTF能够通过血脑屏障。高剂量MTF联合烷基化替莫唑胺(TMZ)协同作用在恶性胶质瘤的体外和体内研究中得到证实。TMZ联合MTF(均为大剂量给药)在GBM细胞48 h和72 h治疗后细胞毒性最强[111]。这种治疗方案伴随着相对最高的细胞凋亡,有效地增加了p-AMPK表达,但减少了p-mTOR, p-Akt和p53的表达。采用高剂量MTF(每天10 mg/25kg)和TMZ(每天15 mg/kg)注射的GBM异种移植物小鼠模型,显示了相对最高的生存时间。在这些条件下,已知与癌症侵袭性相关的脂肪酸合成酶(FASN)在移植瘤中的表达显著降低。使用两种GBM细胞系进行细胞培养实验,发现TMZ耐药的T98G细胞与MTF联合对TMZ细胞增殖有协同抑制作用,而TMZ敏感的U251细胞仅表现出轻微的加性作用[112]。
此外,MTF作为单一药物或联合治疗,在两种细胞系中都比单独使用TMZ更显著地增加了葡萄糖摄取和乳酸释放的速率。在T98G移植瘤小鼠中,联合治疗比单独用药更有效地抑制肿瘤生长。作者得出结论,MTF可能对TMZ耐药患者有益。近年来,MTF效应与作为激素调节剂、抗代谢物、抗生素或DNA功能或蛋白质合成抑制剂的几种化疗药物联合作用的机制得到了详细的综述[113]。例如,MTF联合抗激素化疗药物通过影响基因转录和激素信号通路介导的协同作用,导致细胞周期阻滞和凋亡。MTF联合抗生素治疗的目的是降低心脏毒性。MTF与药物(如顺铂)联合,干扰DNA功能,诱导细胞凋亡,使癌细胞对化疗药物的细胞毒性作用敏感。已知影响蛋白合成的紫杉烷联合MTF机制包括下调ERCC切除修复1、内切酶非催化亚基(ERCC1)和抑制脂质和胆固醇合成。除了与化疗药物的联合应用外,MTF的抗肿瘤能力也已通过与天然化合物如槲皮素(5,7-二羟黄酮)、chrysin(5,7-二羟黄酮)、flavone(2-苯基- 4h -1-苯并吡喃-4- 1)、止痛药和消炎药阿司匹林的联合应用已被成功评估[114,115,116,117]。这些在体外和体内的研究大多表明,MTF与其他药物联合作用以一种添加或协同作用的方式来增强抗癌效果。这些发现很重要,因为MTF耐受性很好,在联合治疗中降低细胞毒性化疗药物的剂量是可行的,而且不会失去疗效。在这方面,一些非小细胞肺癌的同时回顾性和随机研究正在评估MTF联合标准治疗 [118]。
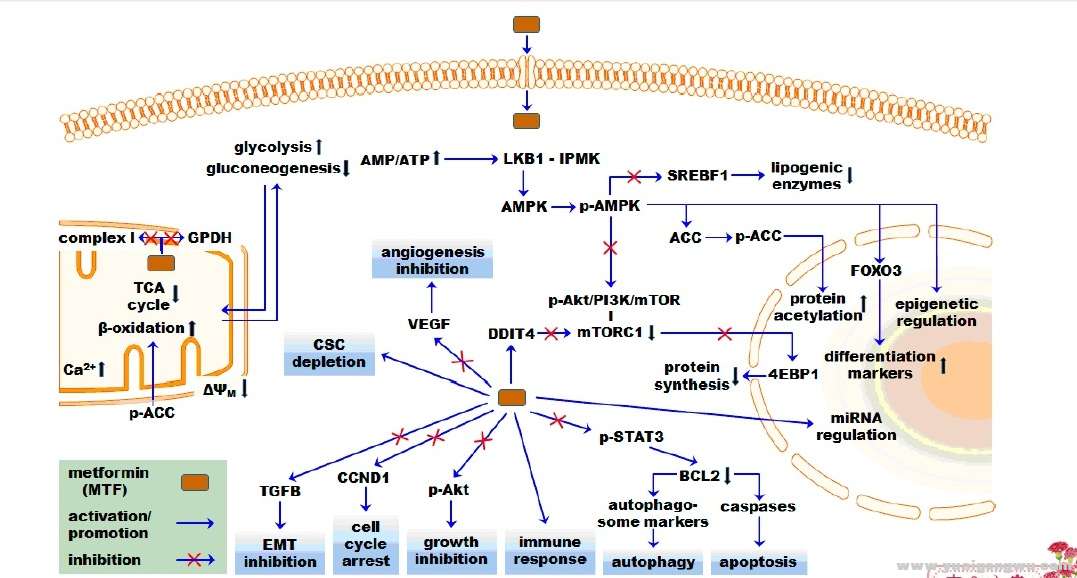
图1:推定MTF具有抗癌作用以分子和细胞关键事件为例。MTF的影响关键能量和代谢过程,如线粒体呼吸(复杂),三羧酸循环、脂肪酸β氧化、糖质新生,糖酵解。MTF会影响细胞周期、细胞生长、EMT、自噬和凋亡等细胞命运过程。AMPK是细胞关键能量传感器,它会对AMP/ATP比率的增加做出磷酸化应答,并参与产生多种多效MTF效应。AMPK依赖性机制包括,例如,通过Akt/PI3K/mTOR通路抑制4EBP1。与AMPK无关的机制包括,例如,DDIT4抑制mTORC1。MTF对基因调控的多效效应包括分化标记的下调、表观遗传和mRNA特征的调控等。磷酸化分子用前缀p表示。
Figure1. Putative anticancereffects of MTF exemplified by molecular and cellular key events. MTF affectskey energy and metabolic processes such as the mitochondrial respiration(complex I), TCA cycle, fatty acid β-oxidation, gluconeogenesis, andglycolysis. MTF affects cellular fate processes such as cell cycle, cellgrowth, EMT, autophagy, and apoptosis. AMPK, the cellular key energy sensor, isphosphorylated in response to an increased AMP/ATP ratio and implicated inexerting several pleiotropic MTF effects. AMPK-dependent mechanisms include,e.g., inhibition of 4EBP1 via the Akt/PI3K/mTOR pathway. AMPK-independentmechanisms include, e.g., inhibition of mTORC1 by DDIT4. The pleiotropiceffects of MTF on gene regulation include, e.g., downregulation ofdifferentiation markers and modulation of epigenetic and mRNA features. Directactivation or inhibition processes are thoroughly known only for a limitednumber of molecules, such as LKB1 activation of AMPK. ΔΨM,mitochondrial membrane potential; 4EBP1, 4E-binding protein 1; ACC, acetyl-CoAcarboxylase; Akt, AKT serine/threonine kinase 1; AMPK, AMP-activated proteinkinase; BCL2, apoptosis regulator, BCL2; CCND1, cyclin D1; CSC, cancer stemcell; DDIT4, DNA damage inducible transcript 4; EMT, epithelial-to-mesenchymaltransition; FOXO3, forkhead box O3; GPDH, glycerol-3-phosphate dehydrogenase;IPMK, inositol polyphosphate multikinase; LKB1, liver kinase B1; miRNA, microRNA; mTORC1, target of rapamycin complex 1; SREBF1, sterol regulatory elementbinding transcription factor 1; STAT3, signal transducer and activator oftranscription 3; TCA, tricarboxylic acid; TGFB1, transforming growth factorbeta 1; VEGF, vascular endothelial growth factor. Phosphorylated molecules areindicated by a prefix p.
3.17. Drug Delivery 给药
New drugdelivering systems are examined to improve efficiency of MTF as a single agentor in combination therapy. For example, MTF and curcumin co-encapsulated inPEGylated poly(lactic-co-glycolic acid) nanoparticles exhibited a synergistantiproliferative effect on T47D breast cancer cells compared to singleencapsulated or non-encapsulated agents [119]. Dual drug loadednanoparticles were associated with higher cytotoxicity and apoptosis indoxorubicin-resistant breast cancer cells compared to the correspondingfree-administered compounds [120].
An MTF-extendedrelease formulation compared to the standard application formulation wasexamined in T2D patients for 24 weeks in a clinical trial (NCT01864174) [121]. Safety and efficacyprofiles, e.g., decrease in HbA1clevels, were similar in both groups with the advantage of the once-dailyapplication in the extended release formulation group.
To increaselocal MTF concentrations at tumor sites, a thermosensitive gel formulation hasbeen developed allowing significant MTF accumulation within tissues and a morecontinuous release of MTF at the application site [122]. In a xenograft mouse model,MTF peritumorally applied at 100 mg dosages with the gel formulation topseudo-orthotopic human breast cancer cell xenografts, led to increased localMTF concentrations, resulting in significantly lower tumor growth with asignificantly lower number of mitotic cells and peripheral vessels. Incontrast, MTF applied as an aqueous solution seemingly did not impair tumor growth.
3.18. MTF-AssociatedResistance and Gene Polymorphisms 二甲双胍相关的耐药和基因多态性
在癌症模型系统和临床环境中观察到对MTF治疗应答的耐药或变异。例如,MTF抗癌作用的局限性在非肥胖、非糖尿病的啮齿动物癌症模型中得到证实,包括羟基丁基(丁基)亚硝胺诱导的侵袭性膀胱癌Fischer-344大鼠模型[123]。在这个模型中,MTF治疗未能降低癌症发病率,尽管MTF治疗导致了三种被研究的丝氨酸残基中的两种p53磷酸化。此外,在大鼠口腔癌模型和小鼠多发肠道肿瘤模型中,MTF均无效。
在癌细胞系和患者来源的细胞培养谱系中,详细研究了MTF敏感和MTF耐药细胞的潜在机制[124]。表达谱和基因测序鉴定出的基因变异,即使是来自同一患者的不同细胞群,也有助于解释MTF治疗的异质性应答,并可能获得优化MTF治疗方案的相关性。
肾细胞癌细胞对长期MTF治疗的耐药性与组蛋白H3乙酰化减少和EMT和干细胞样标志物上调有关。将已知的组蛋白去乙酰化酶抑制剂丙戊酸添加到MTF治疗后的细胞中可以克服耐药性,这种作用与增强组蛋白H3乙酰化和EMT过程的逆转有关[125]。联合治疗的协同细胞毒性被证实,例如降低了p-Akt、p-SMAD3和CDH2的水平。
在一组结直肠癌细胞中观察到与cscs相关的MTF耐药。
MTF (10mM)降低了4个结直肠癌细胞系中CD44+/CD133+ CSCs的比例,而在其他4个结直肠癌细胞系中,MTF没有影响CSCs的数量[126]。在MTF敏感细胞系中观察到肿瘤球数量以剂量依赖性减少。在一个MTF耐药细胞系中,体外实验表明MTF耐药是由谷氨酰胺取代葡萄糖作为能量来源的补偿效应引起的。因此,联合使用MTF和谷氨酰胺酶C抑制剂,降低了MTF耐药细胞系中CSCs的比例。这些结果在异种移植小鼠模型中得到了证实。
也研究了葡萄糖浓度对MTF抗癌效应的影响,如对MTF具有耐药性的高级别浆液性卵巢癌细胞系[127]。低葡萄糖浓度使细胞系对MTF治疗敏感,导致细胞增殖抑制。
获得性MTF耐药机制已在MCF-7乳腺癌细胞系及其耐MTF- 7衍生的分子水平上进行了研究[128]。在MTF耐药细胞中,EMT转化的关键标志物SNAI1的结构性表达增加,而癌细胞的关键上皮标志物CDH1的显著降低。此外,耐药细胞中p-Akt的表达也有相应的上调。
迄今为止,很少有研究涉及与MTF肿瘤应答相关的基因多态性。在人类中,OCT1是MTF的主要肝脏摄取转运体,OCT1中的某些非同义多态性损害了其功能,例如导致更高MTF最大血浆浓度[129]。一项针对MTF应答的全基因组关联研究(GWAS)的荟萃分析发现,溶质载体家族2成员2 (SLC2A2)中的单核苷酸多态性(SNP)与MTF的血糖应答之间存在关联[130]。SLC2A2编码GLUT2葡萄糖转运子。
在包含1300名二型糖尿病T2D患者的病例序列中进行基因分型发现,在患者组中,mRNA前处理因子31 (PRPF31)、羧肽酶A6 (CPA6)和STAT3中常见和罕见的变异与MTF应答有关[131]。
综上所述,几项研究在第三节证明,MTF通过靶向在第一个实例中线粒体的呼吸作用,发挥其多效性的抗癌效果关键代谢、能量和细胞过程包括那些影响血管生成、增殖,自噬,细胞凋亡,EMT(图1)。关键分子包括,例如,ACC, AMPK, BCL2, 4 EBP1,STAT3, TGFB, Akt / PI3K/mTOR通路基因[46,132,133]。进一步的研究将有助于评估分子和代谢MTF效应在啮齿动物模型肿瘤中的直接关系。
4. MTF Effects onCancer: Population-Based Studies, Clinical Studies and Trials, and Recent Meta-Analyses二甲双胍对癌症作用:基于人口研究,临床研究和试验,及最近荟萃分析
4.1. Population-BasedStudies基于人口研究
回顾性队列研究旨在收集关于有效性、副作用、安全性、相互作用和剂量的信息,以改进临床试验的设计。
一些观察性研究估计了MTF使用者与非MTF使用者的一般癌症风险和特定癌症部位的风险,尤其是糖尿病患者。
2005年,一位苏格兰观测试验研究注册数据超过300000居民的泰赛德区1993 - 2001年期间的报道,很少允许到医院的新诊断癌症患者在使用MTF治疗的T2D确认相比于T2D非MTF治疗患者(调整后的优势比(OR)0.77,95%可信区间(CI) 0.64 - -0.92) [134]。在1994-2003年的观察期间,同一研究组后来报告说,4085名T2D MTF使用者中有7.3%被诊断为癌症,而4085名匹配的T2D非MTF使用者中有11.6%被诊断为癌症(调整风险比(HR) 0.63, 95% CI 0.53-0.75)[135]。长期服用最高MTF剂量组的癌症发病率也较低。癌症风险明显降低在肠癌被确认。
一项英国包括63000糖尿病患者回顾性队列研究发现,与磺酰脲类药物、MTF +磺酰脲类药物或胰岛素治疗相比,MTF作为单一药物可降低癌症风险,尤其是结肠直肠癌和胰腺癌的风险[136]。在临床实践研究数据链,一个英国的回顾性队列研究,包括超过51000 MTF T2D用户和超过18000的MTF用户T2D开始使用磺酰脲类, 两组任何类型癌症的风险相似,记录滞后一年 [137]。Zwolle门诊糖尿病项目整合了现有护理(ZODIAC)研究,1353名注册参与者平均随访9.6年,T2D MTF患者与非MTF患者相比,调整后的癌症死亡率HR为0.43 (95% CI 0.23-0.80)[138]。
剂量-应答分析发现随着MTF剂量的增加而死亡率降低。磺酰脲类药物使用和大血管并发症作为干扰因素或排除入组后的前三年没有显著影响癌症死亡率。
据韩国国家糖尿病计划(KNDP)报道,平均随访5.8年,调整人口统计学和临床参数,排除入组后第一年确诊的癌症患者,MTF患者的癌症风险降低(HR 0.513, 95% CI0.318-0.826, p = 0.006)[139]。台湾以人群为基础的群组研究中,近801000人注册的国民健康保险制度和注册第一年无癌研究中,MTF(≤500毫克每天)T2D用户显著降低总患癌症的风险类似与看到非T2D人口水平[140]。MTF应用于单个肿瘤位点的好处不尽相同,部分原因是考虑了可能的干扰因素。使用MTF降低结直肠(调整后的HR 0.36, 95% CI 0.13-0.98)、肝脏(调整后的HR 0.06, 95% CI 0.02-0.16)和胰腺癌(调整后的HR 0.15, 95% CI 0.03-0.79)风险的显著优势被发现;然而,对于结直肠癌和肝癌,使用MTF的获益是有性别差异的。另一项以台湾人口为基础的结直肠癌研究报告指出,该群体T2D患者的风险降低与MTF治疗以剂量依赖的方式相关[141]。
一队列研究报道, 注册护理协会(美国)MTF使用至少五年T2D病人导致整体结直肠癌的风险减少 (HR 0.78,95% CI 0.60 - -1.02),在当前MTF用户(HR 0.78,95% CI 0.59 --1.04),和男性(HR 0.65,95%可信区间0.45 - -0.94)[142]。
在新近诊断为前列腺癌的糖尿病男性患者中,加拿大一项针对前列腺癌特异性死亡的回顾性队列研究(调整后的HR 0.76, 95% CI 0.64-0.89, p= 0.001)显示,MTF治疗每增加6个月,会看到持续时间累积的效果[143]。
然而,MTF与降低全因死亡率的关系随着时间的推移而下降。一项基于人群的前瞻性队列研究(前列腺癌数据库瑞典,PCBaSe)针对T2D患者前列腺癌的研究报告称,仅胰岛素和磺酰脲类药物使用者的癌症风险降低,而MTF患者的风险则没有降低(HR 0.96, 95% CI0.77-1.19)[144]。这些发现可能支持T2D对前列腺癌假定的保护作用[145]。
综上所述,包括上述研究在内的多项以人群为基础的研究都报道,MTF正在降低糖尿病患者的癌症发病率,尤其是一些主要的癌症部位,包括结直肠癌、肝癌和胰腺癌,而对于其他一些肿瘤部位,MTF明显具有轻微或无显著的阳性关联[3]。值得注意的是,MTF治疗似乎与累积剂量和持续时间效应有关。关于MTF应用于癌症的流行病学和观察性研究的批评性评论指出,这些研究在设计上各不相同,大多数都存在影响不同领域的风险偏见,如时间相关干扰因素、暴露定义和基线调整[146,147]。因此,这些研究的结果一定在干扰因素总体上比临床试验更少控制的背景下进行观察。尽管观察队列研究在控制某些干扰因素方面的能力有限,但根据纽卡斯尔-渥太华量表(newcastl - ottawa Scale),近年来,改进设计和执行此类研究的经验显然导致了方法学质量分数的提高[148]。
4.2. Clinical Trialsand Studies 临床试验和研究
将MTF作为治疗选择的临床试验主要集中在最常见的癌症类型。2018年6月在欧盟临床试验登记册上列出的临床试验中,约有三分之一涉及乳腺癌患者的MTF治疗(https://www.clinicaltrialsregister.eu)。其他大量试验包括,例如,妇科和前列腺癌。在一些国家卫生研究所(NHI)批准的临床一期和二期试验中,MTF被评估为单一药物或与其他药物联合使用,即二磺胺和氯喹,用于治疗GBM[149]。最近的一项研究总结称,近70%涉及MTF的临床试验是将该药物与细胞毒性化疗联合使用[150]。例如,在III期试验中,MTF成功地与拉帕替尼和/或曲妥珠单抗联合应用,以提高HER2阳性早期乳腺癌糖尿病患者的远期无病和总体生存率[151]。以下选择的研究和试验包括那些通常不包括在用于癌症的MTF荟萃分析中。
美国癌症中心对接受新辅助治疗的乳腺癌患者进行的回顾性临床研究报道,与糖尿病非MTF患者相比,糖尿病患者的MTF治疗与病理完全应答显著相关[152]。病理完全应答被确定为手术时无浸润性乳腺癌和腋窝淋巴结转移的指征。
在心脏移植术后随访的小病例系列中,只有4%的T2D患者发生癌症,而没有接受MTF治疗的T2D患者中有62%和27%没有T2D患者[153]。在接受MTF的T2D患者组中,五分之二诊断出的癌症是血液学恶性肿瘤,而皮肤癌在另外两组中最为普遍。
在重度预处理癌症患者的I期剂量递增试验中,mTOR抑制剂西罗莫司(每周25毫克)和MTF(每天2克)的最高剂量被大多数患者所耐受[154]。这种治疗方法有一定的疗效。对于患有胰腺神经内分泌肿瘤并接受MTF治疗的糖尿病患者,一项回顾性临床研究表明,与没有接受MTF治疗的患者相比,这些患者的无进展生存期明显更长[155]。
在一项参与者数量有限的回顾性临床研究中,评估了MTF治疗和非MTF治疗的糖尿病甲状腺癌患者以及非糖尿病对照组MTF使用对完全应答的影响[156]。MTF治疗的糖尿病患者肿瘤大小明显更小,糖尿病非MTF患者存在无进展生存期更短的风险。
一些临床研究已经评估了与MTF相关的代谢参数和/或肿瘤生物标志物,如增殖标记物Ki67。在术前4周,非糖尿病乳腺癌患者的MTF治疗显示在体内平衡模型评估(HOMA)指数升高的女性中Ki67肿瘤表达呈下降趋势,而在HOMA指数较低的女性中呈现相反趋势[157]。在一项针对少数乳腺癌患者的新辅助治疗试验中,MTF(每天三次0.5 mg)作为新辅助治疗导致HOMA的显著降低[158]。此外,在一部分癌症病例中,Ki67染色指数明显下降,而Tunel凋亡评分升高。NCIC临床试验小组(NCIC CTG) MA.32对完成乳腺癌手术的非糖尿病患者进行了一项临床试验,报告称在6个月内,MTF组的体重和包括胰岛素、葡萄糖、瘦素和c反应蛋白在内的多项血液参数均有明显改善[159]。
在一项针对肥胖子宫内膜癌患者的小型术前试验中,MTF治疗的应答者被确定为减少Ki67染色的患者[160]。应答者血清中大量脂质代谢物浓度发生变化,p-AMPK在肿瘤中的表达增加,而p-Akt、p-RPS6和磷酸化真核翻译起始因子4E结合蛋白1 (p-EIF4EBP1)表达减少。在子宫内膜癌术前研究中,在MTF治疗下,p-AMPK水平升高,而Ki67、p-RPS6和p-ERK1/2水平降低[161]。非典型子宫内膜增生和子宫内膜癌的研究采用非MTF用户对照组,术前Ki67表达减少,其他指标变化不明显[162]。当使用20%的阈值降低免疫组化表达时,一项关于子宫内膜癌的研究没有发现术前Ki67表达减少[163]。不过,p-Akt和p-ERK1/2(别名p-p44/42MAPK)的表达显著降低。虽然术前的研究时间有限,但这些研究对于识别这些患者群体可能是实用的,这将受益于MTF的长期治疗。
4.3. RecentMeta-Analyses 最近的荟萃分析
MTF应用的荟萃分析,尤其是在糖尿病癌症患者中,经常被用于总结各种设计研究的结果,并可用于识别研究设计和结果之间的因果异质性。它们也足以评价选定出版物的方法学质量。然而,选择荟萃分析的研究的纳入和排除标准差别很大。
2016年,一项关于MTF作为辅助抗癌治疗的荟萃分析报告称,糖尿病根治性放疗早期前列腺癌患者在使用MTF后获益于无复发生存期 (HR 0.45,95% CI 0.29-0.70)。MTF的使用与乳腺癌和尿路上皮癌无正相关关系[164]。
一项对糖尿病癌症患者进行的荟萃分析,其内容与上述荟萃分析重叠,报道称,2017年结直肠癌、子宫内膜癌、乳腺癌、前列腺癌和卵巢癌的全因死亡率显著降低,而对肝癌、胰腺癌和肺癌则没有建立任何正相关关系[165]。
此外,乳腺癌也与降低癌症特异性死亡率显著相关。
表1列出了最近对特定癌症部位的荟萃分析,报告了MTF对癌症发病率和预后的影响。在本质上相同的数据集上重复报告的荟萃分析不包括在内。MTF在胃癌患者中的应用显著降低了所有7项纳入研究的癌症风险(HR 0.763, 95% CI 0.642-0.905),但如果只考虑非台湾研究,其意义就丧失了[166]。
表1:二甲双胍对特定部位癌症的发生率和结果的荟萃分析
Tumor Site
Study Design
Cancer Incidence
CSS/DFS/PFS/RFS
OS/ACM
Number of Participants
Reference
Gastric cancer
7 cohort
HR 0.763, 95% CI 0.642–0.905
>100,000
[166]
Colorectal adenoma
4 retrospective
1 retrospective cross-sectional
2 retrospective case-control
OR 0.86, 95% CI 0.66–1.12, p = 0.274
10,000–100,000
[167]
Advanced colorectal adenoma
3 retrospective
OR 0.51, 95% CI 0.41–0.63, p < 0.001
<10,000
[167]
Colorectal cancer
8 retrospective cohort (OS)
3 retrospective cohort (CSS)
HR 0.84, 95% CI 0.69–1.02, p = 0.079 (CSS)
HR 0.82, 95% CI 0.77–0.87, p = 0.000 (OS)
10,000–100,000
[168]
Liver cancer
10 cohort
9 case-control
2 RCTs
OR 0.52, 95% CI 0.40–0.68, p < 0.001
>100,000
[169]
Lung cancer
13 cohort,
2 case-control (OS)
5 cohort (DFS)
HR 0.50, 95% CI 0.39–0.64, p < 0.0001 (DFS)
HR 0.77, 95% CI 0.68–0.86, p < 0.0001 (OS)
10,000–100,000
[170]
Colorectal cancer
8 retrospective cohort (OS)
3 retrospective cohort (CSS)
HR 0.84, 95% CI 0.69–1.02, p = 0.079 (CSS)
HR 0.82, 95% CI 0.77–0.87, p = 0.000 (OS)
10,000–100,000
[168]
Liver cancer
10 cohort
9 case-control
2 RCTs
OR 0.52, 95% CI 0.40–0.68, p < 0.001
>100,000
[169]
Lung cancer
13 cohort,
2 case-control (OS)
5 cohort (DFS)
HR 0.50, 95% CI 0.39–0.64, p < 0.0001 (DFS)
HR 0.77, 95% CI 0.68–0.86, p < 0.0001 (OS)
10,000–100,000
[170]
Breast cancer
10 retrospective cohort,
1 prospective cohort,
1 nested case-control (cancer incidence)
11 retrospective (ACM)
OR 0.93, 95% CI 0.85–1.03
HR 0.55, 95% CI 0.44–0.70 (ACM)
10,000–100,000
[171]
Endometrial cancer
3 retrospective cohort
1 case-control
1 nested case-control
RR 0.87, 95% CI 0.80–0.95, p = 0.006
>100,000
[172]
Endometrial cancer
9 observational (OS)
5 observational (PFS)
HR 0.61; 95% CI 0.49–0.76 (PFS)
HR 0.58; 95% CI 0.45–0.76 (OS)
<10,000
[173]
Prostate cancer
7 retrospective cohort,
1 prospective cohort (OS)
6 retrospective cohort (CSS)
5 retrospective cohort (RFS)
HR 0.76, 95% CI 0.57–1.02 (CSS)
HR 0.74, 95% CI 0.58–0.95 (RFS)
HR 0.79, 95% CI 0.63–0.98 (OS)
10,000–100,000
[148]
Pancreatic cancer
9 retrospective cohort
2 RCTs
HR 0.86, 95% CI 0.76–0.97, p = 0.01 (OS)
<10,000
[174]
ACM, 全因死亡; CI, 置信区间; CSS,特定癌症生存; DFS,无病生存; HR,风险比; OR, 胜算比; OS, 总生存时间; PFS,无进展生存; RCT,随机参照试验; RFS, 无复发生存; RR, 相关风险.
对七项结直肠腺瘤研究的荟萃分析显示,T2D MTF使用者与T2D非MTF使用者相比没有降低风险(OR 0.86,95% CI 0.66-1.12, p= 0.274);然而,三项关于晚期结直肠腺瘤研究的荟萃分析发现MTF在T2D患者中的使用有显著的益处(OR 0.51,95% CI0.41-0.63, p < 0.001)[167]。
对8项回顾性队列研究进行荟萃分析,其中包括接受MTF治疗的6000多名T2D结直肠癌患者,与近5000名非MTF患者相比,发现总体生存率显著提高(HR 0.82, 95% CI 0.77-0.87, p = 0.000);不过,亚组分析显示结直肠癌相关生存率无显著改善(HR 0.84, 95% CI 0.69-1.02, p = 0.079)[168]。
在一项包含55万多名糖尿病患者的19项研究的荟萃分析中,MTF与非MTF相比降低了48%的肝癌发病率(OR 0.52,95% CI 0.40-0.68, p < 0.001)[169]。一些干扰因素的调整并没有显著改变结果;然而,对纳入的两项随机临床试验的汇总分析显示,MTF和非MTF应用之间没有显著差异。
在两项肺癌病例对照和13项队列研究中,糖尿病MTF患者与糖尿病非MTF患者相比,降低了23%的全因死亡率(HR 0.77, 95% CI 0.68-0.86, p < 0.0001)[170]。5个队列研究报告肺癌进展或复发风险降低,与糖尿病MTF使用者和糖尿病非MTF使用者存在显著相关(HR 0.50, 95% CI 0.39-0.64, p< 0.0001)。
对T2D患者乳腺癌发病率和全因死亡率进行系统综述,评估了12项研究中MTF与乳腺癌发病率的关系和11项研究中死亡率的关系[171]。虽然乳腺癌发病率与MTF应用之间无相关性(OR 0.93,95% CI 0.85-1.03),但全因死亡率降低45%(HR 0.55, 95% CI 0.44-0.70)。然而,这篇综述也指出了一种可能的发表偏见,限制了从观察性研究中得出的结论。
在一个荟萃分析评估MTF用于子宫内膜癌糖尿病患者的获益、子集的病例对照分析,一个嵌套病例对照,三个回顾性队列研究表明MTF使用降低了子宫内膜癌发病率相对风险(相对危险度(RR) 0.87, 95%可信区间0.80 - -0.95,p = 0.006) [172]。然而,当只检查病例对照和嵌套病例对照研究时,这种联系就消失了。对子宫内膜癌的另一项荟萃分析发现,在9项评估研究中,使用MTF对总体生存率有好处(HR 0.58; 95% CI 0.45–0.76) ,5项评估研究中无进展生存(HR 0.61;95% CI 0.49–0.76) [173].
8项回顾性研究(包括基于人群的研究和基于临床的研究)的荟萃分析显示,MTF使用者与非MTF使用者相比,前列腺癌患者的总体生存率有所提高(HR0.79, 95% CI 0.63-0.98)[148]。
从6项研究(HR 0.76, 95% CI 0.57-1.02)和5项研究(HR 0.74, 95% CI 0.58-0.95)得出的癌症特异性生存率的汇总数据表明,MTF使用者的无复发生存率只有显著提高。
在9项回顾性队列研究和2项糖尿病胰腺癌患者随机对照试验的汇总分析中,与非MTF相比,MTF的使用与生存率的改善显著相关(HR 0.86, 95% CI 0.76-0.97, p = 0.01)[174]。在亚组分析中,可切除或局部晚期肿瘤患者(但无转移患者)受益于MTF应用。
总之,这些最近的荟萃分析与一篇综述报告部分整合,认为MTF在一定程度上对某些部位肿瘤的有有利的影响[3]。报道的趋势关联可能意味着在患者中存在更大程度的异质性应答,其中生物标志物检测可能有助于识别那些可能从MTF治疗中获益的患者。
5. Summary总结
Several in vitroand in vivo studies indicate that MTF exerts its pleiotropic anticancer effectsvia key cellular and metabolic processes and molecular pathways. In addition,several studies have demonstrated that MTF specifically targets CSCs and exertsadditive or synergistic effects in numerous combination treatments.
A mechanism thatis likely to contribute to the limited efficacy of MTF observed in severalstudies and trials on diabetic patients is the applicable MTF concentrationthat is below the concentrations used in many in vitro and in vivo studies.However, the anticancer effects of MTF depend, in part, on the affected tumorsite. Besides this, beneficial MTF effects have been observed incancer-associated biomarkers and MTF has been repeatedly reported to beassociated with reduced overall mortality of diabetic cancer patients, whichmight be, in part, attributed to beneficial MTF effects in reducinghyperglycemia and promoting weight loss and vascular protection [171,175,176].It should be noted that MTF has enhanced anticancer effects under lower glucoselevels, which can be a considerable factor in diabetic patients who are in theinitial phase of MTF treatment.
Further studiesare desired that optimize formulas where MTF exhibits additive or synergisticeffects with other anticancer compounds, especially in view of the fact thatcontraindications for MTF are limited. Considering the heterogeneous MTFresponses in cancer patients, it can be envisaged that new test assays aredeveloped to assess individual MTF responses. In addition, more qualityobservational studies and clinical trials with controlled confounding factorsare desired that may lead to the enlargement of therapeutic indications of MTF.
Abbreviations 略缩词
2DG
2-deoxy-d-glucose
ACC
acetyl-CoA carboxylase
AMPK
AMP-activated protein kinase
CI
confidence interval
CSC
cancer stem cell
EMT
epithelial-to-mesenchymal transition
GPDH
glycerol-3-phosphate dehydrogenase
HOMA
homeostasis model assessment
HR
hazard ratio
IC50
half maximal inhibitory concentration(s)
i.p.
intraperitoneal
MTF
Metformin二甲双胍
OR
odds ratio胜算比
OXPHOS
oxidative phosphorylation氧化磷酸化
T2D
type 2 diabetes二型糖尿病
TCA
tricarboxylic acid
TMZ
Temozolomide替莫唑胺
|