http://mp.weixin.qq.com/s?__biz= ... UWcxoIGoPZ1hwM89#rd
: E _% G0 b0 y3 j' D! f+ p: h0 _8 L% Q4 F6 \# V6 L
ALK重排晚期非小细胞肺癌的全程管理
, a1 y+ F* g6 G- O* R% j: n 肿瘤资讯% u& i" H: p. d
从PROFILE1001到PROFILE 1029,中国专家与患者参与了克唑替尼所有重要的I期-III期临床研究,间变性淋巴瘤激酶(ALK)酪氨酸激酶抑制剂(TKIs)治疗在ALK重排的晚期NSCLC患者中可获得非常理想的疗效,但耐药在所不免,本文就ALK重排晚期NSCLC患者的全程管理作一概括,以期对临床有所提示。
' ?: Z1 H- r+ }9 N$ E0 v+ D' c. I4 C G9 T5 t' `
一、背景
5 A0 p" T9 y4 n0 p, K: A; M: \/ w9 Y% ]; u
ALK融合基因发生于3%-7%的NSCLC患者,临床上常见于不吸烟的年轻腺癌患者,通常与EGFR或KRAS突变的发生互相排斥。 一代ALK抑制剂克唑替尼,应用于ALK重排、ROS1重排、MET扩增和MET外显子14跳跃突变的NSCLC患者。然而,克唑替尼一线PFS是10.2月-11.1月,约40%患者发生耐药时以CNS进展为主,表明克唑替尼对颅内病灶控制欠佳,并促使了第二、三代ALK抑制剂的发展与超越:Alectinib及Ceritinib已得到FDA批准的,而二代Brigatinib及三代lorlatinib正处于临床研究阶段。ALK-TKI耐药机理则较复杂,守门基因突变是常见的耐药机制,L1196M突变是克唑替尼常见耐药基因,且二代TKI 可克服,然而二代TKI则会因G1202A突变的产生而发生耐药,lorlatinb(PF-06463922)则对G1202A显示较好的疗效。
: p# q7 V' k5 f- b+ D: p! {; h( J" r8 O1 |2 O. x' C2 `9 C
二、一线用药:克唑替尼# N9 s' \7 u, u7 ?
4 _: V9 j) j2 y
克唑替尼(Crizotinib)是由辉瑞公司研制的抑制Met/ALK/ROS的ATP竞争性的多靶点蛋白激酶抑制剂。一系列3期RCT研究包括PROFILE 1014,PROFILE 1007, PROFILE 1029已有充足证据表明1,克唑替尼在ALK重排NSCLC一线及二线治疗中均优于化疗治疗,无进展生存期得到显著延长。克唑替尼是肿瘤药物研发史上最快速的药物之一,2007研发,2011年在美国上市后引起轰动。而2013年6月发布的《中国间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌诊断专家共识》、《中国表皮生长因子受体基因突变和间变性淋巴瘤激酶融合基因阳性非小细胞肺癌诊断治疗指南》(2013、2014版)推荐,目前针对ALK融合基因检测常用的方法主要有3种:荧光原位杂交(FISH)、基于聚合酶链反应(PCR)扩增基础上的技术和针对融合蛋白表达的免疫组织化学法(IHC)。2015年06月12日FDA批准Ventana ALK(克隆号:D5F3)伴随诊断(Ventana IHC)检测可作为ALK诊断的重要方法之一。
" A' o4 {: [5 ~2 J7 I+ ]& Y" r) e" e! c
三、克唑替尼耐药机制- o- R- s: U" \; E
9 U, K5 W; ^6 ?5 }# W) ^# T) l克唑替尼的应用显著改善了ALK重排NSCLC患者预后,ORR达60%,PFS达8个月-10个月,总生存期显著延长。尽管患者的获益明显,但这部分患者往往在1-2年内出现对克唑替尼耐药,且CNS复发进展较为常见。而克唑替尼耐药机制非常复杂,已经发现的耐药机制有以下几种(见图一)[2]:+ R/ K% {1 h, V5 H" L
1472463774497095914.jpg( x* R' n$ M$ o! n# E
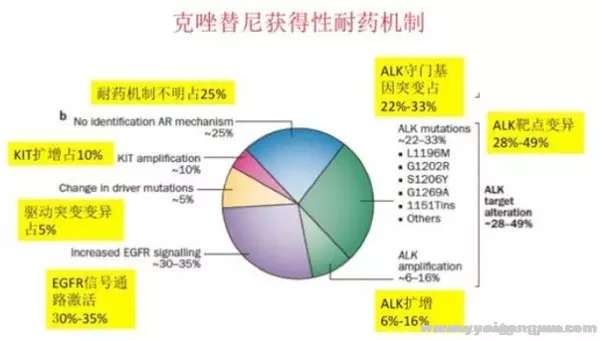
( n& I$ a( C5 U ]; v 1、继发性耐药突变 ALK重排患者出现继发性耐药,28-49%归因于ALK继发性耐药突变。继发耐药的患者存在数种ALK激酶区突变,包括:L1196M、L1152R、G1202R、G1269A、1151Tins、S1206Y、C1156Y、F1174C和D1203N等。数量上微占优势的是L1196M,它是一种类似于T790M的看家基因。ALK融合基因拷贝数扩增首次是在ALK+细胞系出现对克唑替尼耐药时发现的,随后在对克唑替尼耐药的ALK+ NSCLC患者标本中也发现了拷贝数增加,约占6-16%。# P% H2 m" h4 H! ]. r/ g8 s( _
: M* F' P' X: V4 F# B1 x2、 驱动基因转换 当使用克唑替尼阻断ALK通路时,肿瘤细胞会通过激活其他信号通路,取代肿瘤细胞对ALK及其下游信号的依赖,导致克唑替尼耐药。 最为常见的是EGFR突变或磷酸化(30-35%)、c-KIT扩增(10%)及KRAS及其他基因突变(5%)。# l! m0 t6 i4 U/ z
) B7 a' f& {4 `7 \; _- u3、肿瘤异质性 NSCLC是基因和细胞异质性最大的肿瘤之一。对于NSCLC患者而言, 约5%耐药机理未明,异质性可能是解释之一。
* E# P: g3 A2 A1 h( K& a: j1 ~3 [. b3 h) T# t0 K( j/ H* u3 a
四、克服耐药:与肿瘤克隆进化的斗争
4 {7 v4 W# z; @2 u! q! W
! J" T! s) m) X+ c' i, n' k. [# Z' I1、现实世界的选择8 ^! H& q, g0 H- }) X$ ]: x3 e9 {- }
9 U6 ]* f+ `: h0 y9 J' y( B从EGFR-TKI耐药的全程管理中,很多患者即使RECIST评估进展,但仍能从TKI的继续治疗中获益。 局部进展患者,局部治疗的同时,继续使用TKI能取得较长的二次PFS。在ALK阳性患者, 2013年Annual of Oncology的一篇回顾性分析提示,RECIST评估进展后的ALK阳性患者,继续使用克唑替尼能带来生存的获益,其中继续服药组OS为29.6个月优于停药组。当然,进展后继续服药能获益不等于所有患者不加选择的一味继续服药,临床医生应该根据患者耐药模式及再活检基因状态进行综合评估,筛选出可能会从继续服药中获益的患者,同时也要密切监控疾病的进程。8 V3 D9 d% p: @2 S' s6 `
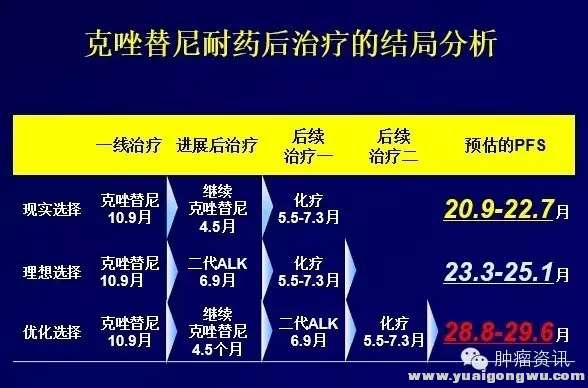
: g/ u' T/ `, M1 w+ [8 d赵琼教授在CSCO分享了ALK阳性NSCLC患者长期生存的挑战:克唑替尼耐药后的治疗结局分析。治疗耐药后的治疗策略包括以下3种:继续克唑替尼或加局部治疗;换二代TKI;改为化疗。同时赵教授对三种模型PFS分析,首次进展后,使用化疗的PFS约为5.5-7.3个月。二代ALK抑制剂约为6.9个月。而继续克唑替尼±局部治疗的PFS为4.5个月,二次进展后,再使用二代ALK抑制剂或化疗,可使患者预估的PFS达到20.9-22.7个月,然而在中国大陆现实世界中的选择是克唑替尼耐药后,继续克唑替尼,后续化疗!(部分患者可通过临床研究获得新一代TKI)
/ B2 R. m7 ]7 w 1472463804148023680.jpg
9 ^1 n0 C% y, H! h, i7 M6 H; i
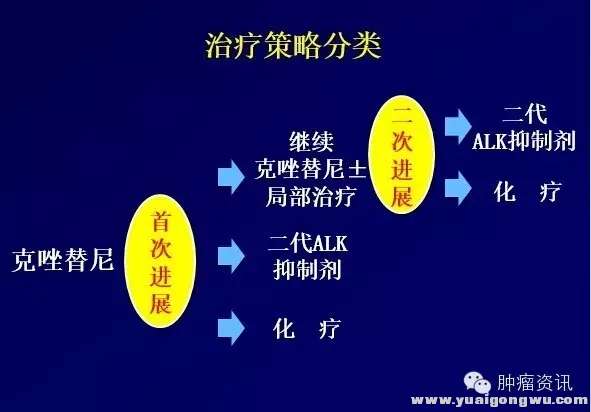
, h3 G5 K# ^" v9 M图二:克唑替尼耐药后治疗模式' V0 L; L) B( }0 P y7 k8 }* ?" e1 W
1472463819272026913.jpg J& u0 e! L! }/ z$ Z9 g! C
 4 I+ y. m) z4 n/ g
4 I+ y. m) z4 n/ g
图三:克唑替尼耐药后不同治疗的结局分析+ x- n8 Z' w' ^+ A ]( }
2 M) o: X6 l- S( H: u7 s2、理想世界的选择
# m/ w6 k' D4 z) Y- u5 D% l
/ Z4 R$ v- m7 w. B' nALK抑制的耐药,是肿瘤克隆演变的动态过程。全程管理过程,进展时再活检,根据耐药机制确定治疗策略非常关键。这就必须提到2016年N Engl J Med报道的成功个案3: 52岁女性ALK阳性NSCLC一线使用克唑替尼达18个月。腹部淋巴结新病灶,再活检提示ALK C1156Y,改用ceritinib治疗,5周后新发多个肝部病灶。改Hp90抑制剂(AUY922)无效。改卡铂联合培美曲塞治疗,缓解6个月。再次使用克唑替尼治疗无疗效。进入lorlatinib的I期研究,疾病缓解持续8月;肝部病灶恶化后,行肝部病灶活检(第3次活检),示 C1156Y-L1198F双突变,且两者突变频率相似,提示这两个突变发生在同一等位基因上,即发生在同一细胞内。而克唑替尼可能抑制这种复杂突变。患者再次使用克唑替尼治疗,肿瘤缓解迅速,缓解长达6个月。进一步对ALK突变进行细胞学和生化特征分析,验证了克唑替尼和certinib对C1156Y的耐药,lorlatinib对L1198F的耐药,克唑替尼对L1198F的敏感,及L1198F与克唑替尼结合亲和力的增加,抵消了C1156Y激酶的活性增加,使得双突变对克唑替尼恢复了敏感。(治疗过程及ALK动态变化见图4、5)- f, |1 S6 |4 H- g/ _1 ]) }
1472463839032018481.png- k1 o1 U! M- G' K
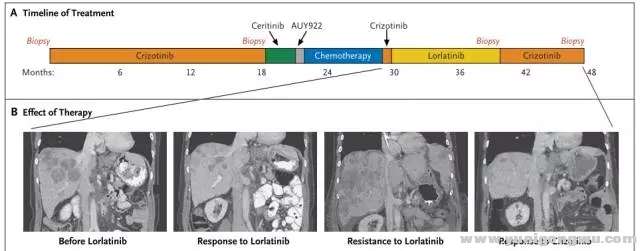
* ^4 R! a, E, d6 l3 F图四 case报道ALK重排患者治疗选择9 s( l- e/ A2 ]( N1 l
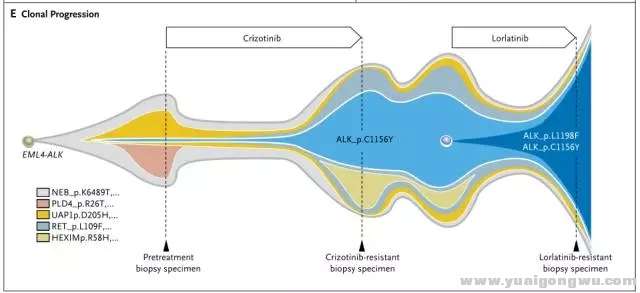
1 O. K. W; T% j, s( ^1472463855718020867.png 图五 case报道ALK重排患者治疗过程再活检ALK基因动态变化 o6 i4 @3 H& R
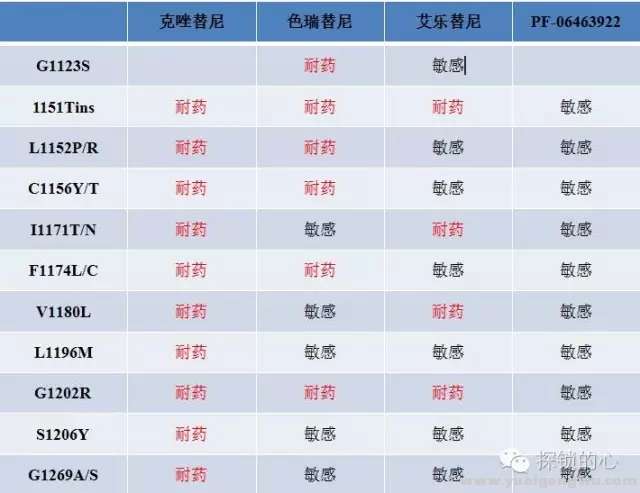
+ F4 R- Q1 b7 x& ~, h理想世界中,克唑替尼耐药后的ALK基因融合患者,可以选用二代ALK基因抑制剂,如色瑞替尼、艾乐替尼、Brigatinib(AP26113)及三代Lorlatinib(PF-06463922)。究竟哪一个位点应选用哪种二代抑制剂,建议再活检,并根据基因状态(所谓的“守门基因突变”是指耐药位点还是产生在ALK基因上)选择相应的TKI,可参考图6总结,但需要更多的证据支持。7 P- v- e4 L. m# E
1472463880886071050.jpg
! S& ]3 K m1 u0 R A7 b; w) o( }
 + @7 V* z: V0 z( n* Y) p. J
+ @7 V* z: V0 z( n* Y) p. J
图六 ALK-TKI耐药突变药物敏感性分析/ N+ b7 o, \0 P; `
7 }$ `, E ^+ g8 }; C- T' d$ v
3、新一代ALK-TKI疗效分析
; b' o! ?% Z% v) q, D* l
* [8 u& y$ c& Yceritinib,LDK378
: D8 D' q; U# ]& s+ o1 `: f' o" ]
' o. X1 t* }" }+ I( A色瑞替尼是二代ALK-TKI, 在体内试验中可通过血脑屏障,且在克唑替尼耐药患者中仍具有临床疗效。发表在2016年lancet oncology的I期临床研究(ASCEND-1)4,结果提示ceritinib在曾接受过克唑替尼的ALK重排患者,可获得持续性的全身缓解及颅内病灶控制, 83名未经ALK-抑制剂治疗的患者中,ORR达72%,163名已接受过ALK-抑制剂治疗的患者中, ORR为56%。未经ALK抑制剂治疗组的中位缓解持续时间为17个月,ALK抑制剂经治组为8.3个月。 未经ALK抑制剂治疗组的中位PFS为18.4个月,ALK抑制剂经治疗组为6.9个月。ceritinib在ALK重排患者,即使是一代TKI进展,仍能获得持续性的全身缓解及颅内病灶控制。一项确认性的2期临床试验正在进行中,评估ceritinib在治疗脑或脑膜转移的ALK重排NSCLC患者中的疗效。ceritinib的获得性耐药机制,目前认为包括基因突变、致癌旁路及药代动力学逃逸等,这与克唑替尼和Alectinib获得性耐药机制较为相似。
1 Y* ~8 f* O( W: j1 K5 U
( I+ Z7 n% H. g) E( m, i! GAlectinib3 A& e$ q5 B" f5 |
% T# \7 O2 u; h- N: J
Alectinib,CH5424602是二代ALK-TKI,可透过血脑屏障,拥有极好的的CNS渗透性,其对ALK的抑制作用高于克唑替尼约5倍,且可抑制大多数克唑替尼耐药的ALK突变。2016年JCO的II期临床研究结果5,经一线TKI治疗的ALK重排患者应用Alectinib, ORR为50%,中位缓解持续时间是11.2月。备受关注的是Alectinib在CNS作用:在35例基线可测量的CNS转移灶患者中,CNS ORR为57%。在23例基线存在CNS转移灶且前期未经放疗的患者中,10例(43%)达到了CNS CR。在治疗的第12个月,33名患者(24.8%)CNS进展,43名患者(33.2%)非CNS进展,随着时间的推移,非CNS较CNS更早出现进展发生率的升高,而死亡累计发生率升高速度显著低于其他事件。提示Alectinib在治疗ALK基因重排且对克唑替尼耐药的晚期非小细胞肺癌(包括存在脑转移)效果显著且耐受性良好,有望为该类患者提供更优的治疗选择。
+ P4 ?- T% [$ S8 h2 V
8 A# p# [8 n* o% F! I8 Y/ i. F而在2016年ASCO J-ALEX研究结果提示:Alectinib组和克唑替尼组的ORR分别为91.6%和78.9%;中位PFS分别为未达到(95%CI:20.3-未达到)和10.2月。 据统计,Alectinib的PFS可能超过24.3m, Alectinib有潜力成为ALK阳性患者的标准一线治疗。 L$ w9 B! W" d2 ?- G
{2 d, }2 V: I$ _0 M
Brigatinib(AP26113)/ [) W, J; j0 s' |! f. k
% q b7 s1 a; p, P6 O
Brigatinib对 ALK 重排和克唑替尼耐药突变均具有临床前活性。R. Rosell教授汇报的Ⅰ/Ⅱ期单臂开放标签的多中心研究(n=137)中6,既往接受克唑替尼治疗的、可评价的ALK阳性NSCLC患者(n=70)ORR为71%,中位无进展生存(PFS)期为13.4个月。基线脑转移患者中,53%(8/15)患者可测量的≥10mm脑转移灶获得颅内病灶的客观缓解;颅内疾病控制率为87%。在颅内缓解的患者(n=19)中,中位缓解持续时间为18.9个月。brigatinib治疗克唑替尼耐药的患者有一定的抗肿瘤活性;未接受克唑替尼治疗的ALK阳性NSCLC患者ORR为100%,包括患者基线有脑转移(可测量病灶的患者中颅内ORR为53%)。
$ ?" P. r+ p( O
3 x" |6 E& I+ p4 J. P& c8 o2016 ASCO的II 期试验(ALTA),入组crizoitnib耐药且未接受其他ALK抑制剂治疗的ALK阳性晚期NSCLC,Brigatinib分两个剂量组:90 mg qd(A组)或90 mg qd 7天后180 mg qd(B组)。222名患者入组(A/B组,n=112/n=110):两组的ORR分别为46%和54%;中位PFS分别获得了8.8个月和11.1个月的,对比之前色瑞替尼(mPFS,6.9m)和艾乐替尼(mPFS,8.9m)用于克唑替尼耐药患者中的数据,Brigatinib似乎更优。值得期待的是,Brigatinib对比克唑替尼用于初治晚期ALK+NSCLC患者一线治疗的III期研究ALTA-1L已经启动。
( z& P( X3 D& \# x6 D. |6 V. p( {6 d5 v% l
Lorlatinib(PF-06463922)
& d# H8 ^" S7 q, n# J; ~" l+ l6 m8 Y& B' I" G& s$ G
Lorlatinib是多靶点的ALK和ROS1抑制剂,为第三代ALK抑制剂正处于临床研究阶段,相比现有的ALK抑制剂,其潜在的优势在于血脑屏障通透性更高,且对TKI耐药的ALK突变的治疗效果更好,包括克唑替尼、艾乐替尼和色瑞替尼耐药的EML4-ALK突变类型(如G1202R突变)3。2016年ASCO报道,lorlatinib对ALK重排的脑转移患者显示了很好的疗效(ORR为31%),在100mg qd剂量组时,进行血浆和脑脊液药物浓度对比,发现lorlatinib能够穿过血脑屏障,脑脊液药物浓度很高,CSF/血浆浓度比在61%-90%。剂量爬坡研究确定了lorlatinib 100mg qd可以耐受,Ⅱ期研究正在进行中,期待更令人兴奋的结果。( o* _* l6 n" d* i9 k& s
8 S) Y5 S8 E$ S3 Z3 H7 ?. [五、总结
" p. I; Q2 y- F ^& [& X7 A, m$ t% B7 }1 Z' ?/ B. ^6 G
自2007年发现ALK重排靶点,到目前已经获批3个靶向药物,晚期ALK阳性NSCLC患者的OS可延长到4年多,研究进展速度惊人。一代药物耐药以后,已批准上市的二代ceritinib及Alectinib,及正在研发的Brigatinib及Lorlatinib都有超过50%的缓解率,且对中枢神经转移均较一代TKI有更好的控制率,尤其Lorlatinib对继发耐药靶点有一个更广泛的抑制,透过血脑屏障能力更强,带来更多的惊喜。同时,在全程管理中也带来了更多新思考:不仅要关注靶向药的PFS,还要个体化治疗,强调再活检的重要性,合理安排TKI用药,最终目的是让患者能有最大的生存获益。 T0 G" ?6 ], Q& A4 s5 p/ m2 W
, p; t) W; T* Z4 x# I! L
References:
6 A$ X+ C, M0 N& U3 u- _9 \( V9 t8 Q1、Solomon BJ, Mok T, Kim D et al. First-Line Crizotinib versus Chemotherapy in ALK-Positive Lung Cancer. New England Journal of Medicine 2014;371:2167-2177.# e4 t- I6 b) U
2、Camidge DR, Pao W, Sequist LV. Acquired resistance to TKIs in solid tumours: learning from lung cancer. 2014;11:473-481.& }" m" _8 M- Z1 o( e1 q3 g2 t
3、Resensitization to Crizotinib by the Lorlatinib ALK Resistance Mutation L1198F.
4 i( Y& j, e* t; Q+ V$ c4、Kim DW, Mehra R, Tan DS et al. Activity and safety of ceritinib in patients with ALK-rearranged non-small-cell lung cancer (ASCEND-1): updated results from the multicentre, open-label, phase 1 trial. Lancet Oncol 2016;17:452-63., i) w, x( F6 p: }' B% D( ?
5、Ou SHI, Ahn JS, De Petris L et al. Alectinib in Crizotinib-Refractory ALK-Rearranged Non-Small-Cell Lung Cancer: A Phase II Global Study. Journal of Clinical Oncology 2016;34:661-668.+ }, I0 g. F4 J% w2 a
6、Rosell R, Gettinger SN, Bazhenova LA et al. 1330: Brigatinib efficacy and safety in patients (Pts) with anaplastic lymphoma kinase (ALK)-positive (ALK+) non-small cell lung cancer (NSCLC) in a phase 1/2 trial. J Thorac Oncol 2016;11:S114. |